Ajustar reacciones químicas consiste en balancear las cantidades de reactivos y productos que intervienen en una determinada reacción.
Denominamos estequiometría a la proporción o relación que existe entre estas cantidades.
Aunque son muy diversas las reacciones químicas que podemos encontrar, dejando a un lado las reacciones nucleares, en todas ellas debe cumplirse la Ley de conservación de la materia: el número de átomos (que no moléculas) implicados en una reacción debe mantenerse constante.
¿Qué es una reacción química
¿Qué es una reacción química y que información brinda? ¿Quieres aprender a ajustar reacciones químicas? Quédate con nosotros, que en el post de hoy lo veremos de forma muy clara y sencilla.
Recuerdas esa receta que tuviste que buscar en Internet para conseguir hacer una tarta de chocolate por el cumpleaños de algún amigo o familiar. Sí, esa que sugería:

Pues bien, la receta nos indica que por cada 300 g de harina que empleemos, serán necesarios 5 huevos, 450 ml de leches, 300 g de chocolate, etc. Todo ello para obtener 4 porciones de tarta. Así, si queremos hacer tarta suficiente para 8 personas, debemos duplicar la cantidad de cada uno de los ingredientes. La relación entre las cantidades de ingredientes usados y las porciones de tarta obtenidas vendría a ser la “estequiometría” de la receta.
Formación del amoniaco
Ahora, pongamos el caso de la formación de amoniaco (NH3) a partir de nitrógeno e hidrógeno molecular. La reacción química que describe el proceso de formación de amoniaco es:
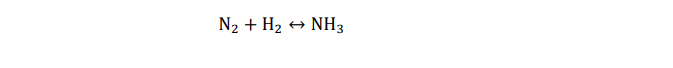
Esta expresión no es más que la “receta” para obtener amoniaco a partir hidrógeno y nitrógeno, que no denominaremos “ingredientes” sino reactivos de la reacción.
Sin embargo, la reacción no está ajustada (no cumple la Ley de conservación de la materia), pues a un lado de la reacción tenemos 2 átomos de nitrógeno y 2 de hidrógeno, y a otro lado 1 sólo átomo de nitrógeno frente a 3 de hidrógeno.
Es necesario ajustar la reacción, y para ello:
- Nos fijamos en el nitrógeno. En el lado izquierdo (reactivos) de la reacción hay 2 átomos y en el lado derecho (productos) sólo uno. Procedemos a colocar un 2 delante de la molécula de amoniaco, de tal forma que el número de átomos de nitrógeno es igual a un lado y otro.
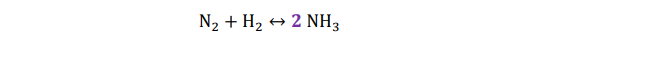
- Tras haber ajustado el número de nitrógenos, en el lado de los productos tenemos 6 átomos de hidrógeno (3 átomos por molécula de amoniaco), por lo tanto, en la parte de los reactivos colocaremos un 3 delante de la molécula de hidrógeno.
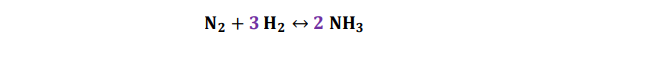
De esta forma, la reacción queda ajustada: el número de átomos implicados se conserva. Denominamos coeficiente estequiométrico al número de moléculas de cada tipo que participan, tanto reactivos como productos, en una reacción química.
La reacción (ajustada) nos indica que por cada molécula de nitrógeno (N2) se necesitan 3 moléculas de hidrógeno (H2) con las que reaccionar para obtener 2 de amoniaco (NH3).
👉Consulta nuestras academias:





Deja una respuesta